Termodinamika
Termodinamika merupakan salah satu cabang ilmu fisika yang berfokus pada energi (terutama energi panas) dan transformasinya. Transformasi energi pada termodinamika berlandaskan pada dua hukum, yaitu hukum pertama termodinamika yang merupakan pernyataan lain dari hukum kekekalan energi dan hukum kedua termodinamika yang memberi batasan apakah suatu proses dapat berlangsung atau tidak. Sebelum mempelajari hukum-hukum termodinamika kita perlu terlebih dahulu memahami apa yang dimaksud sistem dan lingkungan.
Dengan berkembangnya ilmu pengetahuan dan teknologi, maka prinsip alamiah dalam berbagai proses termodinamika direkayasa menjadi berbagai bentuk mekanisme untuk membantu manusia dalam menjalankan kegiatannya. Mesin-mesin transportasi darat, laut, maupun udara merupakan contoh yang sangat kita kenal dari mesin konversi energi, yang merubah energi kimia dalam bahan bakar atau sumber energi lain menjadi energi mekanis dalam bentuk gerak atau perpindahan diatas permukaan bumi.
Hukum-Hukum Termodinamika
Hukum-hukum termodinamika pada prinsipnya menjelaskan peristiwa perpindahan panas dan kerja pada proses termodinamika. Sejak perumusannya, hukum-hukum ini telah menjadi salah satu hukum terpenting dalam fisika dan berbagai cabang ilmu lainnya yang berhubungan dengan termodinamika. Hukum-hukum ini sering dikaitkan dengan konsep-konsep yang jauh melampau hal-hal yang dinyatakan dalam kata-kata rumusannya.
Hukum-hukum dasar yang berlaku di dalam termodinamika,yaitu:
Hukum 0 Termodinamika (Zeroth Law/Hukum ke-0)
Bunyi Hukum 0 Termodinamika :
"Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain"
Hukum I Termodinamika
Hukum I termodinamika menyatakan bahwa untuk setiap proses apabila kalor (Q) diberikan kepada sistem dan sistem melakukan usaha (W), maka akan terjadi perubahan energi dalam (∆U).
Rumus/Persamaan Hukum 1 Termodinamika adalah sebagai berikut:
Q = kalor/panas yang diterima/dilepas (J)
W = energi/usaha (J)
∆U = perubahan energi (J)
Peraturan tanda positif dan negatif adalah sebagai berikut:
1. Q dianggap positif (+) apabila kalor memasuki sistem.
2. W dianggap positif (+) apabila usaha dilakukan oleh sistem.
3. ∆U dianggap positif (+) apabila energi dalam sistem bertambah.
4. Q dianggap negatif (–) apabila kalor keluar dari sistem.
5. W dianggap negatif (–) apabila lingkungan melakukan usaha pada sistem.
6. ∆U dianggap negatif (–) apabila energi dalam sistem berkurang.
Perubahan energi dari sebuah sistem hanya tergantung pada transfer panas ke dalam sistem dan kerja yang dilakukan oleh sistem dan tidak bergantung pada proses yang terjadi. Pada hukum ini tidak ada petunjuk adanya arah perubahan dan batasan-batasan lain.
Hukum pertama Termodinamika dibagi menjadi 4 proses yaitu :
Proses Isotermal ( Suhu Konstan )
Proses isotermal adalah proses yang dialami gas pada suhu tetap. Usaha yang dilakukan gas pada proses ini tidak dapat dihitung dengan persamaan W = p × ∆V . Hal ini dikarenakan tekanannya tidak konstan. Untuk menghitung usaha pada proses isotermal dapat digunakan rumus integral berikut:
atau juga dapat dituliskan
Karena suhunya tetap maka pada proses isotermis ini tidak terjadi perubahan energi dalam ∆U=O, sehingga
Q = W
Dalam berntuk kurva, proses isotermal dapat digambarkan sebagai berikut:
Proses Isobarik ( Tekanan Konstan )
Proses isobarik adalah proses perubahan gas dengan tekanan tetap. Jika Volume gas bertambah berarti gas melakukan usaha atau usaha gas bernilai positif(gas melakukan ekspansi). Sedangkan gas mengalami kompresi jika volumenya berkurang dan usaha gas negatif( dilakukan usaha pada gas).
Usaha yang dilakukan oleh gas pada proses isobarik besarnya sebagai berikut
Sehingga
DU = Q – W
Usaha yang dilakukan gas terhadap lingkungannya atau kebalikannya sama dengan luas daerah bawah grafik tekanan terhadap volume, seperti yang ditunjukkan gambar berikut:
Proses Isokhoris ( Volume Konstan )
Proses isokhoris adalah proses perubahan gas dengan volume tetap. Karena volumenya tetap berarti usaha yang dilakukan gas pada proses isokorik adalah nol.
W = 0
Sehingga
DU = Q
Grafik proses isokhoris adalah sebagai berikut:
Proses Adiabatis ( Kalor Tetap )
Proses adiabatik merupakan proses yang tidak ada kalor yang masuk atau keluar dari sistem (gas) ke lingkungan (DQ = 0) . Hal ini dapat terjadi apabila terdapat sekat yang tidak menghantarkan kalor atau prosesnya berlangsung cepat.
Q = 0
usaha yang dilakukan oleh sistem pada proses adiabatik dapat dituliskan:
W = -DU
Kurva perbandingan isotermal dan Adiabatik
Hukum II Termodinamika
Hukum pertama termodinamika telah menjelaskan bahwa energi dapat diubah dari satu bentuk energi ke bentuk energi lainnya, akan tetapi belum membatasi bagaimana perubahan energi tersebut berlangsung. Hukum kedua ini membatasi perubahan energi mana yang dapat terjadi dan yang tidak.
Bunyi Hukum II Termodinamika dalam pernyataan aliran kalor :
"Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya."
Hukum II termodinamika dalam pernyataan tentang mesin kalor
“Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar”
Hukum II termodinamika dalam pernyataan entropi
“besaran termodinamika yang menyertai perubahan setiap keadaan dari awal sampai akhir sistem dan menyatakan ketidakteraturan suatu sistem”


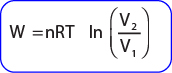





Tidak ada komentar:
Posting Komentar