Contoh Soal Jari-Jari Lintasan Stasioner - Kalian telah mengetahui perkembangan teori atom yang dikemukakan oleh para ahli. Secara garis besar, mereka menggambarkan atom terdiri atas inti atom yang dikelilingi oleh elektron (seperti planet-planet mengelilingi matahari). Sekarang, kalian akan mempelajari jari-jari lintasan stasioner elektron yang terdapat dalam atom.
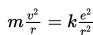
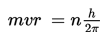
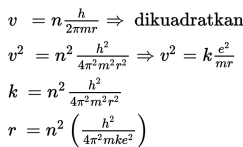
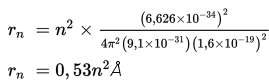

Tentang:
Fisika
VRTM-459 https://woof.tube/stream/WurD9XHqCPS
1. Jari-Jari Orbit Elektron
Elektron yang mengelilingi inti bekerja dua gaya, yaitu gaya Coulomb () dan gaya sentripetal (). Lintasan elektron merupakan lintasan stasioner sehingga . Mengingat dan maka
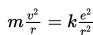
Bohr menyatakan bahwa pada lintasan stasioner, elektron memiliki momentum sudut sebagai berikut.
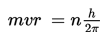
Dengan demikian, besar kecepatan dan jari-jari elektron adalah
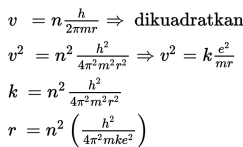
Dengan memasukkan tetapan-tetapan yang ada, yaitu h = 6,626 × 10–34 Js, m = 9,1 × 10–31kg, k = 9 × 109 Nm2/C2, dan e = 1,6 × 10–19 C maka jari-jari lintasan stasioner (kulit atom) dapat ditentukan sebagai berikut.
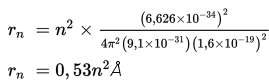
Orbit elektron yang paling dekat dengan inti adalah elektron dengan n = 1 dengan jari-jari dirumuskan sebagai berikut.
r1 = 0,53 Å × 12
r1 = 0,53 Å
r1 = 0,53 Å
Dengan menggunakan bilangan kuantum elektron (n = 1, 2, 3, ...) diperoleh jari-jari orbit elektron (jari-jari kulit atom) K, L, M, ....
Secara umum, jari-jari atom ditulis sebagai
Secara umum, jari-jari atom ditulis sebagai
rn = n2r1
Perbandingan jari-jari orbit elektron atau kulit atom dengan bilangan kuantum adalah
r1 : r2 : r3 : ... = (n1)2 : (n2)2 : (n3)2 : ...
r1 : r2 : r3 : ... = 12 : 22 : 32 : ...
rK : rL : rM : ...= 1 : 4 : 9 : ...
r1 : r2 : r3 : ... = 12 : 22 : 32 : ...
rK : rL : rM : ...= 1 : 4 : 9 : ...
2. Bentuk Orbital (Jari-Jari) Atom
Dalam tiap orbital, elektron menyebar di sekitar inti. Penyebaran elektron dalam mengisi orbital sering disebut awan elektron. Sebaran elektron di dalam orbital bersifat tidak merata. Akibatnya, terdapat bagian yang berkonsentrasi elektron besar dan ada bagian dengan berkonsentrasi elektron kecil. Bagian yang memiliki konsentrasi muatan elektron besar dikatakan rapatan elektronnya tinggi, sedangkan bagian dengan konsentrasi muatan elektron kecil dikatakan rapatan elektronnya rendah.
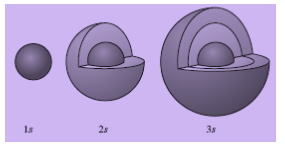
a. Bentuk Orbital s
Orbital s memiliki rapatan elektron yang sama pada jarak yang sama dari inti. Titik-titik yang menggambarkan rapatan elektron pada jarak yang sama terletak pada permukaan bola dengan inti atom sebagai pusatnya. Oleh karena itu, orbital s dikatakan berbentuk bulat (spherical).

Gambar Diagram rapatan elektron pada orbital s
Orbital s dengan tingkat energi yang berbeda akan memiliki beberapa perbedaan. Perbedaan itu dapat diamati dengan cara membandingkan rapatan elektronnya. Rapatan elektron pada orbital 2s akan semakin rendah jika posisinya semakin jauh dari inti. Suatu saat, rapatan tersebut dapat mencapai nol. Akan tetapi, kerapatan elektron dapat bertambah, kemudian berkurang lagi. Orbital 2s dan 3s memiliki dua lapis awan elektron.

Gambar Permukaan orbital s
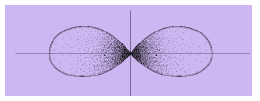
b. Bentuk Orbital p
Rapatan elektron pada orbital p tidak didistribusikan simetris seperti bola. Rapatan elektron itu terpusat pada dua daerah yang sama ukurannya, tetapi letaknya berseberangan. Kedua pusat orbital membentuk satu garis lurus dengan inti.

Gambar Orbital p
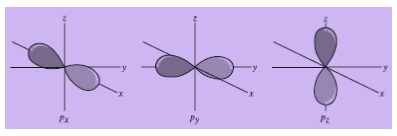
Ada tiga orbital p, yaitu px, py, dan pz. Ketiga orbital tersebut mempunyai bentuk, ukuran, dan energi yang sama. Perbedaan ketiga orbital itu terletak pada arah konsentrasi rapatan elektronnya. Arah tiap orbital terhadap sumbu X, Y, Z ditunjukkan dengan indeks bawah. Arah tiap orbital itu saling tegak lurus.
Ada tiga orbital p, yaitu px, py, dan pz. Ketiga orbital tersebut mempunyai bentuk, ukuran, dan energi yang sama. Perbedaan ketiga orbital itu terletak pada arah konsentrasi rapatan elektronnya. Arah tiap orbital terhadap sumbu X, Y, Z ditunjukkan dengan indeks bawah. Arah tiap orbital itu saling tegak lurus.

Gambar Bentuk dan posisi ketiga orbital p
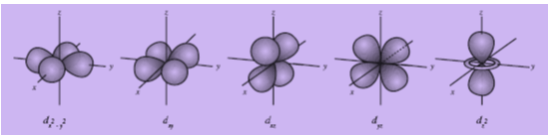
c. Bentuk Orbital d
Orbital d lebih rumit daripada orbital p. Oleh karena itu, penggambaran orbital d selalu terpisah. Walaupun demikian, dalam sebuah atom semua orbital berimpit pada inti yang sama.

Gambar Bentuk dan arah kelima orbital d
Tidak semua orbital d terlihat sama. Empat orbital d yang ditandai dengan dxy, dxz, dyz, dan dx2-y2 mempunyai bentuk yang sama. Masing-masing memiliki empat cuping rapatan elektron. Faktor yang membedakan keempat orbital tersebut adalah arah. Orbital d yang tidak sama dengan keempat orbital itu ditandai dengan dz2 .
SOAL 1
Pada saat elektron berputar mengelilingi inti, gaya yang bekerja adalah ....
SOAL 2
Elektron yang mengelilingi inti memiliki lintasan ....
SOAL 3
Untuk menentukan besar kecepatan elektron dalam mengelilingi inti, persamaan yang digunakan adalah ....
SOAL 4
Panjang jari-jari elektron yang paling dekat dengan inti adalah ....
SOAL 5
Jari-jari atom dengan bilangan kuantum n = 2 adalah ....
SOAL 6
Perbandingan jari-jari untuk kulit atom K dan M adalah ....
SOAL 7
Jika diketahui k = 9 × 109 Nm2/C2, e = 1,6 × 10–19 C, massa elektron m = 9,1 × 10–31 kg, dan r1 = 0,528 Å, maka jari-jari atom hidrogen yang berada pada n = 4 adalah ....
SOAL 8
Jika diketahui h = 6,6 × 10–34 Js, m = 9,1 × 10–31 kg, dan r1 = 0,528 Å, maka kecepatan elektron atom hidrogen pada orbit n = 2 adalah ....
SOAL 9
Momentum sudut elektron yang memiliki bilangan kuantum n = 2 adalah ....
SOAL 10
Jika k = 9 × 109 Nm2/C2, e = 1,6 × 10–19 C, m = 9,1 × 10–31 kg, dan r1 = 0,528 Å, maka gaya elektrostatik yang bekerja pada bilangan kuantum n = 4 adalah ....

Tidak ada komentar:
Posting Komentar