Pengertian Gas Ideal
Pada suhu tertentu benda padat dan cair memiliki volume yang tetap, sehingga perubahan volumenya dapat dihitung dengan menggunakan persamaan pemuaian volume. Sedang zat dalam wujud gas memiliki karakteristik yang berbeda.
Gaya yang bekerja antaratom pada sangat lemah sehingga pada banyak kasus dilakukan pendekatan bahwa gaya tersebut didapat diabaikan. Oleh karena itu tidak ada kesetimbangan jarak antar atom, dan volume nya tergantung wadah yang ditempati gas tersebut. Jadi persamaan pemuaian volume pada zat padat dan zat cair tidak berlaku pada gas.
Berdasarkan eksperimen diketahui bahwa semua gas dalam kondisi kimia apapun mempunyai hubungan sederhana tertentu di antara sifat-sifat makroskopisnya, yaitu tekanan, volume dan temperatur. Pada umumnya hubungan antara tekanan, volume, dan temperatur sangat rumit. Akan tetapi untuk gas pada tekanan rendah atau gas dengan densitas rendah hubungan ketiganya menjadi cukup sederhana dan dapat ditentukan dengan percobaaan. Gas dengan densitas rendah tersebutlah yang biasa ditunjukkan dengan gas ideal. Pemodelan gas ideal ini bertujuan untuk membuat sebuah pendekatan yang dapat menjelaskan karakteristik dari gas pada tekanan rendah yang sesungguhnya.
Gas ideal merupakan gas yang memenuhi asumsi-asumsi berikut.
1. Suatu gas terdiri atas molekul-molekul yang disebut molekul. Setiap molekul identik (sama) sehingga tidak dapat dibedakan dengan molekul lainnya.
2. Molekul-molekul gas ideal bergerak secara acak ke segala arah.
3. Molekul-molekul gas ideal tersebar merata di seluruh bagian.
4. Jarak antara molekul gas jauh lebih besar daripada ukuran molekulnya.
5. Tidak ada gaya interaksi antarmolekul; kecuali jika antarmolekul saling bertumbukan atau terjadi tumbukan antara molekul dengan dinding.
6. Semua tumbukan yang terjadi baik antarmolekul maupun antara molekul dengan dinding merupakan tumbukan lenting sempurna dan terjadi pada waktu yang sangat singkat (molekul dapat dipandang seperti bola keras yang licin).
7. Hukum-hukum Newton tentang gerak berlaku pada molekul gas ideal.
Persamaan Gas Ideal
Hukum Boyle
Hukum Boyle dikemukakan oleh fisikawan Inggris yang bernama Robert Boyle. Boyle melakukan percobaan dan pengamatan untuk mengetahui hubungan antara tekanan dan volume gas dalam suatu ruangan tertutup pada suhu konstan. Hubungan antara tekanan dan volume gas pada ruang tertutup tersebut dikenal dengan Hukum Boyle.
Hukum Boyle menyatakan bahwa jika dalam suatu ruang tertutup terdapat gas ideal dengan suhunya konstan, tekanan gas berbanding terbalik dengan volume gas.
Secara matematis hukum Boyle dapat dituliskan:


dengan:
p1 : tekanan gas pada keadaan 1 (N/m2)
p2 : tekanan gas pada keadaan 2 (N/m2)
V1 : volume gas pada keadaan 1 (m3)
V2 : volume gas pada keadaan 2 (m3)
Jadi pada suhu tetap, jika tekanan gas dinaikkan, volume gas akan mengecil. Jika tekanan diturunkan, volume gas akan naik.
Hukum Charles
Hukum Charles dikemukakan oleh fisikawan Prancis bernama Jacques Charles. Charles menyatakan bahwa jika tekanan gas yang berada dalam bejana tertutup dipertahankan konstan, maka volume gas sebanding dengan suhu mutlaknya.
Secara matematis hukum Charles dapat dituliskan:


dengan:
T1 : suhu mutlak gas pada keadaan 1 (K)
T2 : suhu mutlak gas pada keadaan 2 (K)
V1 : volume gas pada keadaan 1 (m3)
V2 : volume gas pada keadaan 2 (m3)
Hukum Gay lussac
Hukum Gay Lussac dikemukakan oleh kimiawan Perancis bernama Joseph Gay Iussac. Gay Lussac menyatakan bahwa jika volume gas yang berada dalam bejana tertutup dipertahankan konstan, maka tekanan gas sebanding dengan suhu mutlaknya.
Secara matematis hukum Gay lussac dapat dituliskan:


dengan:
p1 : tekanan gas pada keadaan 1 (N/m2)
p2 : tekanan gas pada keadaan 2 (N/m2)
T1 : suhu mutlak gas pada keadaan 1 (K)
T2 : suhu mutlak gas pada keadaan 2 (K)
Hukum Boyle-Gay Lussac
jika hukum Boyle, hukum Charles, dan hukum Gay Lussac digabungkan, maka diperoleh hukum Boyle-Gay Lussac. Persamaan hukum Boyle-Gay Lussac sebagai berikut.

Hukum Boyle-Gay Lussac berlaku untuk gas ideal yang massa dan jumlah mol gasnya tetap. Jika massa dan jumlah mol gasnya tidak tetap maka persamaannya menjadi.

Jadi yang dimaksud dengan persamaan gas ideal adalah

dengan:
n = jumlah mol gas
R = tetapan umum gas (8,314 J/mol K)
Mengingat bahwa jumlah mol gas (n) merupakan perbandingan antara massa gas dengan massa molekul relatifnya (M). Secara matematis jumlah mol adalah sebagai berikut:
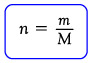

Jadi persamaan gas ideal juga dapat dituliskan

Jika kita ingin mencari masa jenis suatu gas, maka persamaan diatas dapat dituliskan:

Persamaan gas ideal juga dapat dinyatakan dalam jumlah partikel gas tersebut. Ingat bahwa berdasarkan konsep mol,
jumlah partikel gas merupakan hasil kali jumlah mol gas tersebut dengan bilangan avogadro:


Jika persamaan diatas disubtitusikan ke persamaan gas ideal akan diperoleh:

Karena k = R/NA , jadi jika dinyatakan dalam jumlah partikel gas, persamaan ideal dapat dituliskan dengan:

dengan:
N = jumlah partikel gas
NA = bilangan Avogadro (6,023 x 1023 molekul/mol)
k = tetapan Boltzman (1,38 x 10-23 J/K)
Tidak ada komentar:
Posting Komentar