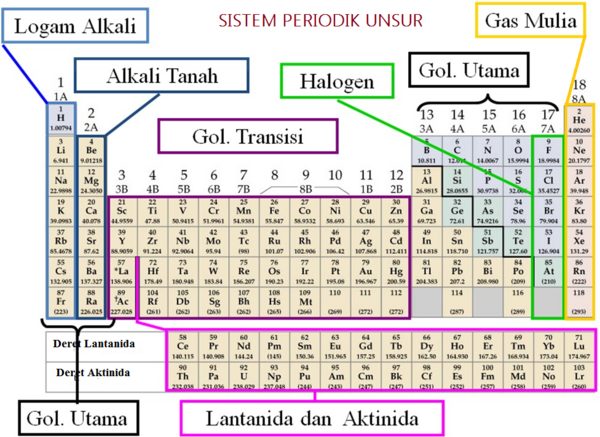
Contoh Soal Sifat Periodik Unsur - Dalam tabel periodik unsur, untuk satu periode, sifat nonlogam suatu unsur akan bertambah dari kiri ke kanan dan berlaku sebaliknya. Sifat nonlogamnya akan berkurang dari kanan ke kiri. Dengan kata lain, sifat logamnya semakin bertambah. Hal tersebut karena dari kiri ke kanan elektron valensinya bertambah, sedangkan dari kanan ke kiri elektron valensinya berkurang. Pada umumnya, unsur logam terdapat pada golongan IA, IIA, dan IIIA, sedangkan unsur nonlogam terletak pada golongan IVA, VA, VIA, VIIA, dan VIIIA. Semua unsur transisi (golongan B) merupakan unsur logam. Batas antara logam dan nonlogam tidak jelas sebab ada unsur yang dapat bersifat logam dan nonlogam seperti B, Si, Ge, As, Sb, dan Te. Unsur-unsur itu disebut unsur semilogam atau metaloid.
Tentang:
Contoh Soal Fisika

Tabel Sistem Periodik Unsur (sumber: www.deviantart.com)
Unsur-unsur yang terletak di sebelah kiri bawah unsur-unsur metaloid merupakan unsur logam, sedangkan unsur-unsur yang terletak di sebelah kanan atas unsur-unsur metaloid merupakan unsur nonlogam.
▄▄▄ Jari-Jari Atom ▄▄▄
Jari-jari atom adalah jarak antara pusat inti atom sampai lintasan elektron terluar. Dalam satu golongan, dari atas ke bawah jari-jari atom semakin besar karena kulit atomnya semakin besar. Dalam satu periode, dari kiri ke kanan jari-jari atom semakin kecil. Hal tersebut karena dalam satu periode, dari kiri ke kanan jumlah kulit atomnya sama, akan tetapi jumlah muatan inti atom dan muatan elektronnya semakin besar sehingga daya tarik inti atom terhadap elektron menjadi semakin kuat.
▄▄▄ Energi Ionisasi ▄▄▄
Dalam atom, elektron diikat oleh inti. Pada keadaan dasar, elektron atom hidrogen terikat di dalam inti dengan energi ikat sebesar E = –13,6 eV. Elektron tersebut dapat menyerap energi dari luar akibat bertumbukan dengan elektron lain atau penyinaran dengan foton. Jika menyerap energi dari luar, elektron tersebut akan mengalami eksitasi atau pindah ke tingkat energi yang lebih tinggi. Jika energi yang diserap elektron 13,6 eV, ternyata elektron tepat akan lepas dari ikatannya. Dengan kata lain, elektron tepat akan pindah ke orbit n = ∞.
Ketika elektron berpindah lintasan menuju n = ∞, maka elektron tersebut akan berubah menjadi elektron bebas yang tidak terikat inti dan atom yang kehilangan elektronnya akan berubah menjadi ion. Energi yang dapat menyebabkan elektron tepat lepas dari ikatannya disebut energi ionisasi. Dengan kata lain, energi ionisasi adalah energi yang diperlukan untuk membangkitkan elektron ke lintasan n = ∞ atau terlepas dari ikatan inti.
Apabila energi yang diterima elektron pada atom hidrogen lebih dari 13,6 eV, sisanya digunakan untuk bergerak sebagai energi kinetik (Ek). Sebaliknya, apabila energi yang diterima itu kurang dari 13,6 eV, elektron hanya akan mengalami eksitasi bukan ionisasi. Ionisasi atom hidrogen dapat ditulis sebagai berikut.
Ketika elektron berpindah lintasan menuju n = ∞, maka elektron tersebut akan berubah menjadi elektron bebas yang tidak terikat inti dan atom yang kehilangan elektronnya akan berubah menjadi ion. Energi yang dapat menyebabkan elektron tepat lepas dari ikatannya disebut energi ionisasi. Dengan kata lain, energi ionisasi adalah energi yang diperlukan untuk membangkitkan elektron ke lintasan n = ∞ atau terlepas dari ikatan inti.
Apabila energi yang diterima elektron pada atom hidrogen lebih dari 13,6 eV, sisanya digunakan untuk bergerak sebagai energi kinetik (Ek). Sebaliknya, apabila energi yang diterima itu kurang dari 13,6 eV, elektron hanya akan mengalami eksitasi bukan ionisasi. Ionisasi atom hidrogen dapat ditulis sebagai berikut.
H + 13,6 eV → H+ + e–
Energi ionisasi suatu atom menunjukkan kestabilan konfigurasi elektronnya. Semakin besar energi ionisasi suatu atom, semakin sulit atom itu untuk melepaskan elektron dari ikatannya. Berdasarkan tabel periodik, unsur-unsur golongan gas mulia (He, Ne, Ar, Kr, Xe, Rn) mempunyai energi ionisasi paling besar. Adapun unsur-unsur yang mempunyai energi ionisasi paling rendah adalah golongan logam alkali, yaitu Li, Na, K, Rb, dan Cs. Pada gas mulia, kulit terluarnya terisi penuh elektron. Akibatnya, elektron-elektron itu terikat lebih kuat. Itulah sebabnya, unsur-unsur gas mulia sukar bereaksi dengan unsur-unsur golongan lain. Sebaliknya, pada logam alkali, kulit terluarnya hanya terisi sebuah elektron. Akibatnya, elektron itu mudah lepas dari ikatannya. Itulah sebabnya, atom golongan alkali mudah berubah menjadi ion.
▄▄▄ Afinitas Elektron ▄▄▄
Pada peristiwa ionisasi, sebuah atom berubah menjadi ion positif karena melepaskan elektron. Sebaliknya, apabila menangkap elektron, atom berubah menjadi ion negatif. Jika pada ionisasi diperlukan energi, sebaliknya pada pembentukan ion negatif dibebaskan energi. Energi yang dibebaskan atom pada saat menangkap elektron dari luar dinamakan afinitas elektron. Atom-atom yang mempunyai energi ionisasi rendah, maka afinitas elektronnya juga rendah, sedangkan atom-atom yang mempunyai energi ionisasi tinggi, afinitas elektronnya juga tinggi. Contoh peristiwa afinitas elektron adalah sebagai berikut.
Cl + e– → Cl– + energi
Ikatan ionik antar atom terjadi jika ada sebuah elektron atau lebih berpindah dari atom yang memiliki energi ionisasi rendah ke atom lain yang memiliki afinitas elektron tinggi. Molekul NaCl terjadi karena adanya ikatan ionik diantara keduanya. Energi ionisasi Na adalah 5,1 eV, sedangkan afinitas elektron Cl adalah 3,8 eV sehingga energi yang diperlukan agar terjadi reaksi adalah 5,1 eV – 3,8 eV = 1,3 eV.
Na + Cl– (1,3 eV) → Na+ + Cl– → NaCl
Atom Na mempunyai 1 elektron pada kulit terluar yang terdapat pada subkulit s (3s1). Atom Na lebih mudah melepaskan elektron untuk membentuk ion Na+ daripada menangkap elektron dari luar. Sementara itu, atom Cl yang pada kulit terluarnya terisi 7 buah elektron (3s2, 3p5), lebih mudah menangkap 1 elektron daripada melepaskan 1 elektron. Hal itu disebabkan setiap atom cenderung untuk berada dalam keadaan stabil. Keadaan stabil akan tercapai jika konfigurasi elektron pada subkulit terluar dalam keadaan penuh atau setengah penuh. Dalam hal ini, subkulit terluar atom Cl cenderung menangkap 1 elektron agar subkulit terluarnya terisi penuh. Itulah sebabnya, atom Na dan Cl mudah sekali bereaksi membentuk molekul NaCl.
Atom-atom dalam golongan gas mulia (He, Ne, Ar, Kr, Xe, Rn) konfigurasi elektron kulit terluarnya sudah terisi penuh.
Atom-atom dalam golongan gas mulia (He, Ne, Ar, Kr, Xe, Rn) konfigurasi elektron kulit terluarnya sudah terisi penuh.
He = 1s2, Ne = 2p6, Ar = 3p6, Kr = 4p6, Xe = 5p6, dan Rn = 6p2
Pada keadaan seperti itu, semua elektronnya telah membentuk pasangan spin. Elektron yang telah membentuk pasangan spin berada dalam keadaan stabil. Itulah sebabnya, unsur gas mulia sulit bereaksi (melepas atau menangkap elektron).
SOAL 1
Unsur-unsur gas mulia dalam sistem periodik unsur terletak pada golongan ....
SOAL 2
Kelompok logam alkali yang memiliki valensi +1 terletak di golongan ....
SOAL 3
Energi ikat yang terdapat dalam atom hidrogen pada keadaan dasar adalah ....
SOAL 4
Jika energi yang diterima elektron pada atom hidrogen lebih dari 13,6 eV, maka energi sisanya digunakan untuk ....
SOAL 5
Unsur berikut yang termasuk ke dalam golongan gas mulia adalah ....
SOAL 6
Berikut ini pernyataan yang benar mengenai afinitas elektron adalah ....
SOAL 7
Jari-jari elektron dalam suatu lintasan sebesar rn= 0,53 n2 Å. Jari-jari elektron pada kulit kedua adalah ....
SOAL 8
Jika nomor atom dalam satu golongan semakin kecil, maka faktor yang bertambah besar adalah ....
SOAL 9
Dalam urutan unsur 8O, 9F, dan 10Ne, jari-jari atom akan ....
SOAL 10
Keelektronegatifan suatu unsur merupakan sifat yang menyatakan ....

Tidak ada komentar:
Posting Komentar